-
2016年中國醫藥行業發展情況分析
2016/12/28 10:37:02 來源:中國產業發展研究網 【字體:大 中 小】【收藏本頁】【打印】【關閉】
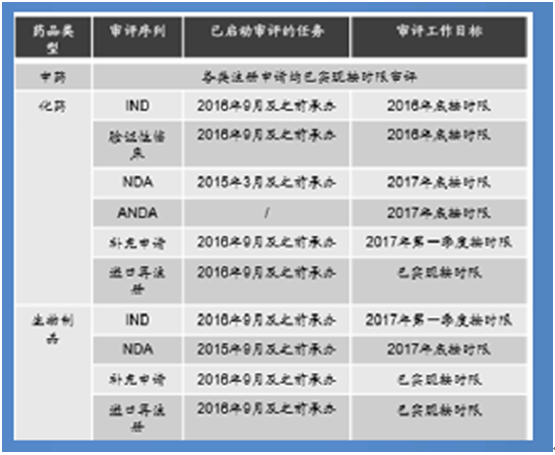
核心提示:CDE評審計劃數據來源:公開資料整理制度改革以來,審評存量大幅下降藥審進展數據來源:公開資料整理臨床申請首先大幅獲批,占總數65%,未來 審評工作重點在上市申請中展開,預計2017 年完成該類申請6000多件,共近9000件,是 2CDE評審計劃
數據來源:公開資料整理
制度改革以來,審評存量大幅下降
藥審進展
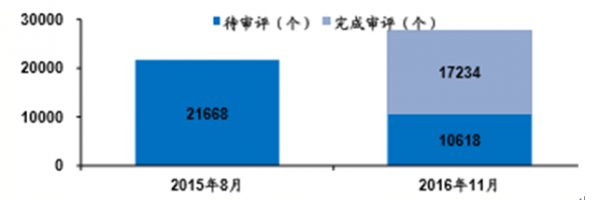
數據來源:公開資料整理
臨床申請首先大幅獲批,占總數65%,未來 審評工作重點在上市申請中展開,預計2017 年完成該類申請6000多件,共近9000件,是 2007-2014年的總和
藥審進展
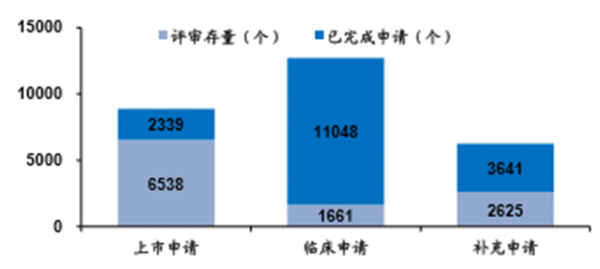
數據來源:公開資料整理
鼓勵研究和創制新藥:設臵特殊審評程序,加快創新藥審評審批;MAH制度
特殊審批程序:6個月 普通新藥申請:至少19個月
防止艾滋病等疾病的創新藥;列入國家科技重大專項的藥品;轉移到 境內生產的創新藥和兒童用藥、采用先進技術、治療優勢明顯的創新藥。
已將9批146個注冊申請納入優先審評

數據來源:公開資料整理
納入優先評審的國產藥品(個)
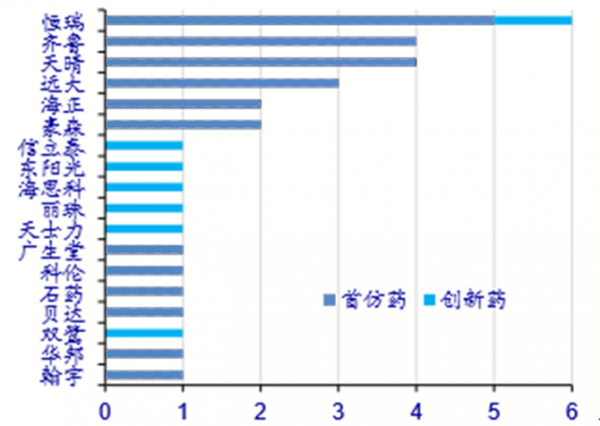
數據來源:公開資料整理
納入優先評審的國產藥類型分布(個)
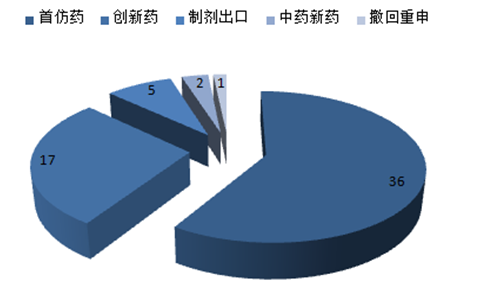
數據來源:公開資料整理
未來幾年中國制藥行業的投資機會主要集中在創新藥、首仿藥、出口仿制藥 和通過一致性評價的超級普藥幾個領域。
藥品量價定性分析
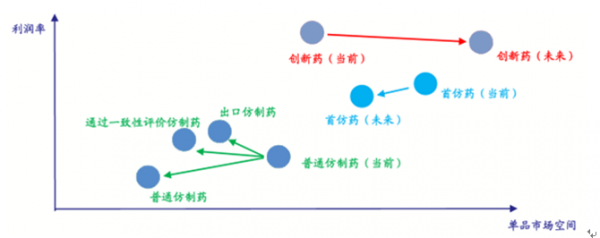
數據來源:公開資料整理
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息之目的,如有侵權行為,請第一時間聯系我們修改或刪除,郵箱:cidr@chinaidr.com。